酶切反应条件的优化
酶切反应条件的优化
当建立内切酶酶切反应体系时有几个关键因素需要考虑。比如,如何在反应体系中加入适量的 DNA、内切酶和缓冲液,就可以获得最佳酶切效果。根据定义,在 50 μl 反应体系中,1 单位的限制性内切酶可以在 60 分钟内完全切割 1 μg 的底物 DNA。上述酶、DNA 与总反应体积的比值可以作为建立反应体系的参考数据。但是,目前大多数科研人员会遵循下表中所列的标准反应条件,使用 5-10 倍过量酶切 DNA,这样有利于克服由于 DNA来源不同、质量和纯度不同而造成的不利因素。省时反应体系用于带有 Time-Saver 标记的限制性内切酶,省时内切酶可以在 5-15 分钟切割 DNA。此外,RE-Mix 限制性内切酶预混液也可以使用。NEB 整理了以下有关内切酶反应的经验和技巧,以帮助您实现最佳酶切效果。
标准反应体系:
限制性内切酶
10
units*
DNA
1 µg
10X NEBuffer
5 µl (1X)
总反应体系
50
µl
温育温度
因酶而异
温育时间
60 分钟
*足够切割所有类型的
DNA。
省时酶切反应体系:
限制性内切酶
1 µl
DNA
1 µg
10X NEBuffer
5 µl (1X)
总反应体系
50 µl
温育温度
因酶而异
温育时间
5-10 分钟*
*具有省时酶切特性的内切酶也可以过夜反应而没有星号活性。
内切酶
• 从冰箱取出后请一直置于冰上。
• 酶最后加入到反应体系中。
• 加入酶之前将反应混合物混匀,可以用移液枪上下吹打或轻弹管壁,然后在离心机中快速离心。切忌振荡混 匀。
• 一般情况下,我们推荐使用 5-10 单位酶量/μg DNA,基因组 DNA 用 10-20 单位酶量消化 1 小时。
• NEB 推出一系列的高保真(HFTM)内切酶,为建立酶切反应体系提供了更多便利,有关高保真酶的更多信息。
DNA
• 避免酚、氯仿、酒精、EDTA、变性剂或过多盐离子的污染。推荐在纯化过程中多清洗几次。
• 甲基化的 DNA 会抑制某些酶的切割效率。
关于甲基化更多信息请登陆 www.
neb- china.com 及
www.neb.com。
缓冲液
• 使用终浓度为 1X 的缓冲液。
• BSA 已被添加到 NEB 缓冲液 1.1、1.2、1.3 和 CutSmart 缓冲液中,无需额外添加 BSA。
• 在不需要 BSA 即可达到最佳活性的酶切反应中如果加入 BSA 也不会影响酶切效果。
反应体系
• 建议在 50 μl 反应体系中消化 1 μg 底物 DNA。
• 加 入内切酶的量应不超过总体积的 10%,以避免甘油过量引起的星号活性。
• 内切酶贮存液中的添加物(如:甘油和盐)和底物溶液中尚存的残余物(如:盐、EDTA 或乙醇)会导致小体 积反应出现问题。下述为小体积反应技术指南。
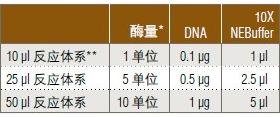
酶切反应体系的选择
* 当内切酶用量小时,用推荐稀释液稀释后使用。
**使用 10 μl 反应体系时,温育时间不要超过 1 小时,以防蒸发。
温育时间
• 标准体系温育 1 小时,省时酶切体系温育 5-15 分钟。
• 使用省时内切酶。
• 许多内切酶都可以用更少单位的酶消化16小时。详情请登陆 www.neb-china.com 及 www.neb.com。
终止反应
若消化后的 DNA 不需要进行后续实验操作:
• 用终止液终止反应 [50% 甘油、50 mM EDTA(pH 8.0)和 0.05% 溴酚蓝](如 NEB #B7021)。按每 50 μl反应体系中加入 10 μl 的比例进行。
若消化后的 DNA 需要进行后续实验操作:
• 用 热失活法(参见 2013﹒2014 商品目录 278-283 页或登陆 www.nebchina.com 及 www.neb.com,以确定该酶能否热失活)。
• 若该酶不能热失活,利用商业化的离心柱或酚/氯仿抽提去除内切酶。
贮存
• 大多数内切酶建议保存在
-20℃。只有少数内切酶若贮存时间超过30
天建议保存在 -70℃。
详细的贮存信息请参阅
www.neb.com 及
www.neb-china.com。
• 10X NEBuffer 也应保存在 -20℃。
稳定性
• NEB 每 4 个月都会对所有的内切酶进行活性检测。使用期限标注在每管产品的标签上。
• 在任何情况下,都应尽可能的避免将酶置于高于 -20℃ 的温度下。
对照反应
如果在切割底物 DNA 时遇到了问题,建议加入以下对照实验:
• 酶切对照 DNA(含有多个已知内切酶切割位点的 DNA,如 Lambda DNA 或腺病毒-2 DNA),以检测内切酶的活性。
• 如果对照 DNA 能够被切割而实验中的底物 DNA 不能,可以将这两种 DNA 混合在一起再进行酶切,以检测实验用的底物 DNA 中是否存在抑制反应的物质。如果确实存在某种抑制因子(通常为盐、EDTA 或酚),则混合之后对照 DNA 也不能被切割。
星号活性
• 当内切酶在非最适条件下使用时可能会产生星号活性(详细信息请参考 2013﹒2014 商品目录 285 页内
容)。
• 可以通过以下方法降低星号活性:使用高保真(HF)内切酶
双酶切反应
使用两种限制性内切酶同时切割一种底物 DNA(双酶切反应)是一种常见的省时方案。超过 200 种的限制性内切酶在CutSmartTM 反应缓冲液中有 100% 的活性,这使得双酶切反应更加简便。如果您使用的限制性内切酶提供的不是CutSmartTM 反应缓冲液,请参考限制性内切酶的活性表(参考 2013﹒2014 商品目录 278-283 页),它列出了每一种限制性内切酶在四种标准反应缓冲液中的活性。
双酶切反应体系的建立
• CutSmart 限制性内切酶的双酶切可以在CutSmart 反应缓冲液中进行。否则,选择两种酶都有活性的反应缓冲液进行双酶切反应。如果担心有星号活性,建议使用高保真(HF)限制性内切酶。
• 按推荐条件建立反应体系。反应体系中甘油的终浓度应< 5%,以避免星号活性(见 2013﹒2014 商品目录 285 页)。例如,50 μl 反应体系中总酶量 ≤ 5 μl。
• 如果需要两种不同温育温度,先选择合适的反应缓冲液,加入第一种酶在适合的温度下反应,热失活第一种酶后再加入第二种酶按推荐温度温育。
• 非最佳反应缓冲液中反应时,适当调整酶量和反应时间,以期克服非最佳反应条件带来的不利因素。
使用特殊缓冲液时双酶切体系的建立(特殊缓冲液代号为“U”)
• NEB 目前有三种限制性内切酶提供特殊缓冲液:EcoRI、SspI 和 DpnII。在大部分情况下,DpnII 需要进行分步酶切。请注意 EcoRI 有 HF 形式的高保真酶,是提供 CutSmart 缓冲液的。

分步酶切体系的建立
• 如果没有一个共同的缓冲液使得两种限制性内切酶的活性均大于 50%,就需要进行分步酶切。
• 分步酶切应从推荐缓冲液盐浓度低的酶开始,温育至酶切完毕。
• 调整缓冲液中盐浓度(用小体积浓缩盐溶液)直至满足第二种酶的要求。
• 加入第二种酶完成双酶切反应。
• 也可在第二步酶切反应前过柱纯化 DNA。
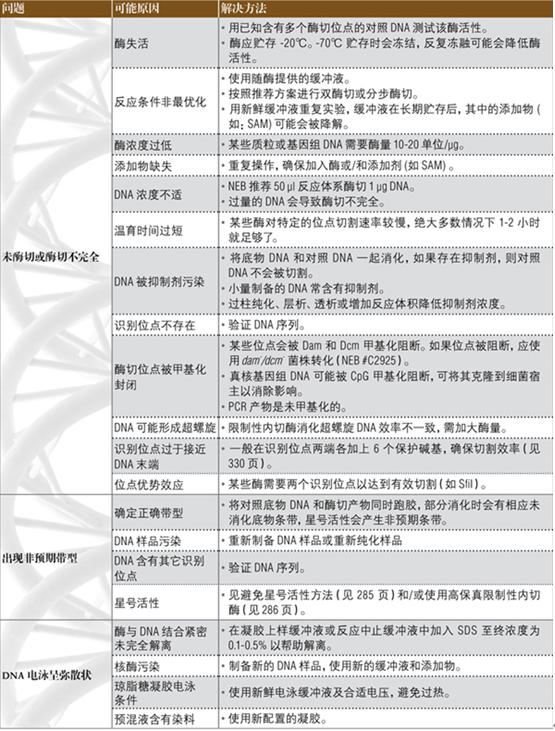
实验问题指南
- 上一篇:IF 实验操作步骤 2020/3/18
- 下一篇:CST—免费申请 COVID-19 研究试剂 2020/3/17
